Classificatie
WHO-classificatie
| WHO | Kenmerken | Opmerkingen |
|---|---|---|
| Nodulair lymfocyten predominante HL (NLPHL) |
CD15-, CD30-, CD20+, CD45+, CD79a+, PAX5+, EBV- PA: popcorn of L&H cellen |
10% van de HL, m.n. mannen tussen 30-50 jaar. Presentatie in hals, oksels of liezen, 80-95% stadium I-II Recidiveert frequent |
| Klassieke HL | CD15+(-), CD30+, CD20- (+), CD45-, PAX5+, EBV+/- | |
|
PA: nodulair patroon, collageen banden en lacunaire cellen | 70% van de HL, 80% in mediastinum |
|
PA: klassieke RS cellen in ontstekings achtergrond | 20-25% van de HL, vaak stadium III-IV |
|
PA: meestel nodulair patroon, zelden diffuus patroon. | 5% van de HL, meestal stadium I-II. Door immunofenotype te onderscheiden van NLPHL |
|
PA: veel RS cellen | < 5% van de HL. Vaak stadium III-IV |
Stagering (Ann-Arbor)
| Stadium | Definitie | |
|---|---|---|
| Beperkte ziekte | ||
| I | I | 1 lymfklier regio of een groep van aan elkaar grenzende klieren |
| IE | 1 extranodale laesie zonder nodale betrokkenheid | |
| II | ≥ 2 lymfklier regio’s aan één kant van het diafragma of | |
| IIE | Stadium I of II t.g.v. nodale uitbreiding met beperkte aangrenzende extranodale betrokkenheid | |
| II bulky* | Stadium II met “bulky” disease | |
| Gevorderde ziekte | ||
| III | lymfklieren onder en boven het diafragma, lymfklieren boven het diafragma met miltbetrokkenheid | |
| IV | extralymfatische betrokkenheid (niet als gevolg van directe doorgroei) | |
| A | = afwezigheid van koorts, nachtzweten en ≥ 10% gewichtsverlies in 6 maanden | |
| B | = aanwezigheid van één of meer hiervan | |
| X | = bulky disease (klier of massa ≥ 10 cm (exclusief lever en milt) of mediastinale massa > 1/3 van de thoraxdiameter op enig niveau met CT-scan; voor EORTC risicoclassificatie > 0.35 Mediastinum/Thorax ratio op niveau T5-T6) | |
|
* stadium II bulky disease wordt behandeld als beperkte dan wel als gevorderde ziekte afhankelijk van histologie en prognostische factoren |
||
Prognose
Stadium I en II boven het diafragma
Naast de klassieke stadium indeling volgens Ann Arbor speelt ook de risicoclassificatie op basis van de aan- of afwezigheid van de volgende prognostische factoren een rol bij de initiële behandelkeuze:
- Tumorgrootte (bulk)
- Aantal aangedane klierregio’s
- Aan- of afwezigheid van B-symptomen
- Extranodale doorgroei
- Leeftijd
- Bezinkingssnelheid
GHSG risico classificatie
| Risicofactor | Geen risicofactoren (early stage) | Wel risicofactoren (intermediate stage) |
| Bezinking / B-symptomen | A + BSE < 50 mm | A + BSE ≥ 50 mm |
| B + BSE < 30 mm | B + BSE ≥ 30 mm | |
| én | of | |
| MT ratio* | < 0.35 | ≥ 0.35 |
| én | of | |
| Aantal aangedane klier regio’s | 2 of minder | 3 of meer |
| én | of | |
| Extranodale aantasting | afwezig | aanwezig |
|
* Breedte mediastinale tumor/thorax diameter op niveau Th5 gemeten op staande X-Thorax |
||
Figuur 1. Definitie lymfeklierregio’s conform GHSG en EORTC
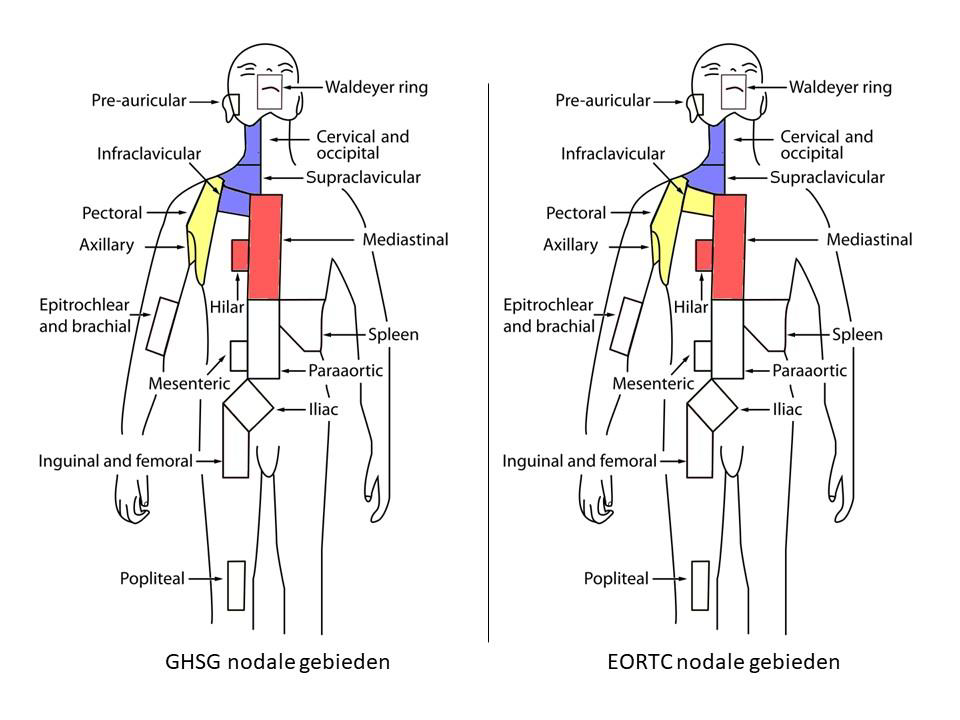
EORTC risico classificatie voor supradiafragmaal stadium I-II HL
| Risicofactor | geen risicofactoren (favorable) | wel risicofactoren (unfavorable) |
| Leeftijd | < 50 jaar én |
≥ 50 jaar of |
| Bezinking/B-symptomen | A + BSE < 50 mm B + BSE < 30 mm én |
A + BSE ≥ 50 mm B + BSE ≥ 30 mm of |
| MT ratio* | < 0.35 én |
≥ 0.35 of |
| Aantal aangedane supradiafragmale klier regio’s # | 3 of minder | 4 of meer |
| * Breedte mediastinale tumor/thorax diameter op niveau Th5 gemeten op staande X-thorax A: afwezigheid van B-symptomen B: aanwezigheid van B-symptomen #: zie figuur 1 voor EORTC definities lymfklierregio’s |
||
Stadium III en IV
International prognostic score (IPS) for advanced Hodgkin’s lymphoma (Hasenclever criteria): Negatieve prognostische factoren voor “freedom from progression of disease”. Afgeleid van: A prognostic score for advanced Hodgkin’s disease. D. Hasenclever and V. Diehl for the International Prognostic Factors Project on Advanced Hodgkin’s Disease. N. Engl. J. Med. 1998; 399: 1506-1514.
| Factoren | Punten |
|---|---|
| Serum albumine < 40 g/l | 1 |
| Hemoglobine < 6.5 mmol/l | 1 |
| Mannelijk geslacht | 1 |
| Stadium IV | 1 |
| Leeftijd ≥ 45 jaar | 1 |
| Leukocyten ≥ 15 x 109/l | 1 |
| Lymfocyten < 0.6 x 109/l, of < 8% van leukocyten | 1 |
Onderzoek
Diagnostisch onderzoek
- Volledig bloedbeeld + differentiatie, bloedgroep, BSE.
- Nierfuncties, leverenzymen incl. LDH, glucose, albumine.
- Serologie (viraal: hepatitis B, C, HIV, EBV).
- EBV-PCR
- PA diagnose op lymfklierhistologie, inclusief gerichte immunohistochemie (geen cytologie).
- Beenmergbiopt hoeft niet standaard verricht te worden voor de stadiëring, indien een gecombineerde PET-diagnostische CT scan is verricht. De PET scan is sensitiever dan het beenmergbiopt voor het aantonen van disseminatie in het beenmerg.
- Op indicatie morfologie, histologie van punctaten (bloed, liquor, pleuravocht, ascites, BAL-vloeistof) en extranodale lesies.
- X-thorax (voor bepalen mediastinum-thorax ratio).
- Whole body FDG-PET scan in combinatie met diagnostische CT-scan met contrast van hals, thorax, abdomen inclusief liezen (< 4 weken voor aanvang therapie)
- Op indicatie zwangerschapstest.
- Indien gewenst consult andrologie/gynaecologie voor fertiliteitsonderzoek en advies, sperma invriezen.
- Longfunctie inclusief diffusiecapaciteit (vastleggen uitgangsituatie bij bleomycine gebruik)
- Elektrocardiogram (ECG).
- LV ejectiefractie (echografisch of MUGA voor vastleggen uitgangssituatie wegens antracyclines) .
Elke lokalisatie dient zo nauwkeurig mogelijk te worden vastgelegd (kliergrootte als het product van de twee grootste loodrecht op elkaar staande doorsneden in mm x mm, diameter long/milt/leverhaarden, etc).
Follow-up en nacontrole
Bij deze patiënten bestaat een verhoogd risico op late complicaties ten gevolge van de behandeling, m.n. secundaire tumoren en hart- en vaatziekten. Actief screenen op het voorkomen van tweede tumoren wordt alleen aanbevolen voor secundair mammacarcinoom bij vrouwen. Voor andere tumoren is er onvoldoende bewijs dat dit effectief is.
Voor de follow-up geldt:
- eerste jaar eens per 3 maanden
- tweede jaar eens per 4 maanden
- derde jaar eens per 6 maanden
- vierde en vijfde jaar eens per jaar
- Na het 5e jaar: zie verder bij Nacontrole Beter Poli
- Het routinematig maken van controle CT scans en PET scans in de follow-up is niet nodig (buiten trial verband) en wordt afgeraden. Follow-up van mediastinale restmassa’s is niet nodig als de PET scan negatief is na afloop van de therapie.
Behandeling
Algemeen
- Indien dragerschap hepatitis B: overweeg entecavir in overleg met hepatoloog.
- Als de milt bestraald gaat worden of hyposplenisme: pneumokokken, meningokokken serogroep C en haemophilus influenza type B vaccinatie.
- Patiënt dient altijd vóór de start van chemotherapie te worden gezien door de radiotherapeut indien gecombineerde behandeling (chemotherapie plus radiotherapie) is gepland in verband met het maken van een plannings-CT scan in radiotherapie positie.
- Patiënt dient altijd voor start van de therapie en bij therapie wijzigingen besproken te worden in het multidisciplinaire overleg van de tumorwerkgroep hematologie.
- Behandeling in principe in trialverband. Indien niet in trial, dan is de behandeling in principe gelijk aan de standaardarm van de trial, tenzij anders vermeld.
- In alle eerstelijns behandelschema’s is een interim FDG-PET scan (zonder diagnostische CT-scan) na 2 cycli opgenomen. Bij ABVD optimaal op dag 10-14 en bij escBEACOPP optimaal op dag 17-21.
- Stel chemokuren zo min mogelijk uit en doseer optimaal.
- ABVD wordt in principe niet uitgesteld of gereduceerd wegens milde neutropenie (> 0.2 x 109/l), omdat dit geen aanleiding geeft tot complicaties.
- Bij aanhoudende neutropenie (<0.2 x 109/l) kan gestart worden met G-CSF.
- Indien gebruik van G-CSF: geef G-CSF ook bij de volgende kuren indien neutropenie de reden van uitstel is. Nooit samen met de cytostatica, dus pas starten op dag 2 bij ABVD en dag 4 bij escBEACOPP.
- Als het bloedbeeld bij start van de volgende kuur (ondanks G-CSF) onvoldoende hersteld is (zie tabellen), stel de kuur dan 1 week uit met het doel alsnog volledig te kunnen doseren. Is het herstel na 1 week onvoldoende pas dan de kuur zonodig éénmalig aan.
- Overweeg portacath bij recidiverende thromboflebitis.
- Bleomycine kan acute longtoxiciteit veroorzaken. Dit kan subtiel beginnen met prikkelhoest en/of verminderde inspanningstolerantie. Verricht X-thorax/CT thorax en longfunctie plus diffusiecapaciteit bij pulmonale klachten. Bleomycine moet uit het chemotherapieschema gelaten worden bij bleomycine toxiciteit.
- Vinblastine en vincristine kunnen polyneuropathie geven. Pas zo nodig de dosis aan.
- Brentuximab kan longtoxiciteit en polyneuropathie veroorzaken.
Responsevaluatie
Responsevaluatie en Deauville score FDG-PET scan (5-punten schaal)
Cheson BD, et al. The Lugano classification. (J Clin Oncol 2014; 32: 3059-3067)
| Score | Uptake PET scan |
|---|---|
| 1 | Geen FDG opname |
| 2 | Opname ≤ mediastinum |
| 3 | Opname > mediastinum ≤ lever |
| 4 | Opname enigszins meer dan de lever |
| 5 | Opname aanmerkelijk meer dan de lever en/of nieuwe lesies |
| X | Nieuwe gebieden met verhoogde FDG opname, waarschijnlijk geen HL |
- Complete metabole respons (CMR): Deauville 1, 2 of 3
- Partiële respons (PR): Deauville score 4 of 5 met afname in vergelijking met de stadiërings-scan
- Stabiele ziekte: Deauville score 4 of 5 zonder significante verandering in FDG-opname van de stadiërings-scan
- Progressieve ziekte: Deauville score 4 of 5 met een toename in mate van FDG-opname in de vergelijking met de stadiërings-scan en/of nieuwe FDG-avide foci die kunnen passen bij HL
- In de ring van Waldeyer of in een orgaan met extranodale ziekte met een hoge fysiologische opname, of bij activatie in de milt of beenmerg zoals bij behandeling met G-CSF, kan de opname hoger zijn dan de activiteit in het mediastinum en/of lever. CMR kan dan worden verondersteld als de opname op oorspronkelijke plekken niet hoger is dan omgevend weefsel, zelfs als het weefsel een hoge fysiologische opname heeft
Therapie nodulair lymfocyten predominante Hodgkin lymfoom (NLPHL)
Het NLPHL is een aparte entiteit en wordt niet standaard als Hodgkin lymfoom behandeld. Er bestaat een levenslang risico op recidief, tevens is er een kleine kans op ontaarding naar een NHL (3%-5%).
- Stadium I en complete resectie: IN-RT of wait and see.
- Stadium I-II: IN-RT.
- Stadium III-IV: individualiseren, behandelen als klassiek HL met toevoeging van rituximab.
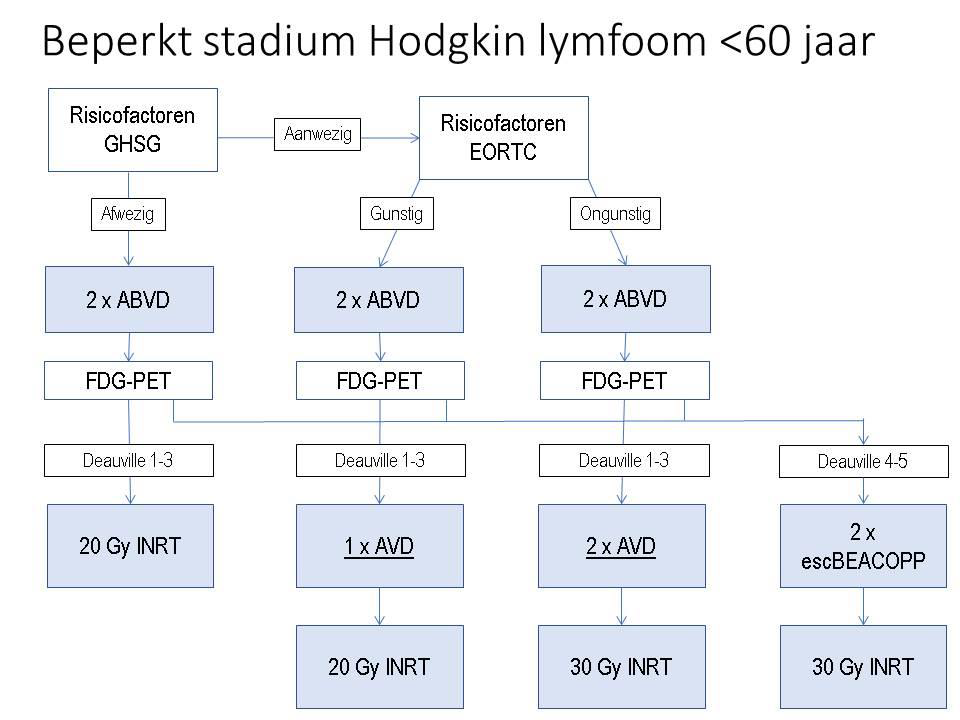
Therapie klassiek Hodgkin lymfoom, beperkt stadium I en II – boven diafragma
Patienten < 60 jaar
- De meest optimale therapie van een stadium I-II HL bestaat uit de combinatie van chemotherapie en radiotherapie.
- Het aantal ABVD kuren voorafgaand aan radiotherapie wordt vastgesteld met behulp van een risicoclassificatie gebaseerd op de aan- of afwezigheid van bekende prognostische factoren.
- Om de minst toxische behandeling te selecteren wordt geadviseerd bij het beperkt stadium HL de GHSG en EORTC risicoclassificatie in hiërarchische volgorde te gebruiken voor het initiële behandelplan bij diagnose en de therapie na 2 ABVD kuren verder aan te passen o.g.v. een interim FDG-PET scan. Dus kijk eerst of patiënt classificeert in de “early stage” van de GHSG.
- Na 2 cycli ABVD wordt een interim FDG-PET scan verricht.
- Bij een negatieve interim FDG-PET scan na 2 cycli ABVD (Deauville score 1,2 of 3): zie algoritme beperkt stadium HL < 60 jaar. De bleomycine kan worden weggelaten uit de vervolgkuren.
- Bij een positieve interim FDG-PET scan na 2 cycli ABVD (Deauville score 4 of 5) is gebleken dat escalatie naar 2 escBEACOPP plus INRT een verbetering geeft van de progressie vrije overleving met ruim 13% (Andre et al. 2017). Zie algoritme beperkt stadium Hodgkin lymfoom < 60 jaar.
- Indien radiotherapie onwenselijk is op basis van grote bestralingsvelden met betrokkenheid van hart, longen en/of mammae dan dienen deze patiënten behandeld te worden conform gevorderd stadium met start ABVD.
Responsevaluatie einde behandeling:
- in geval van negatieve interim FDG-PET scan hoeft gezien de hoge predictieve waarde voor progressie vrije overleving en het korte tijdsinterval niet standaard een FDG-PET scan herhaald te worden aan het eind van de chemotherapie, maar kan volstaan worden met de plannings-CT scan ten behoeve van de radiotherapie. Ook na de radiotherapie wordt herhalen van de FDG-PET scan niet geadviseerd.
- in geval van een positieve interim FDG-PET scan dient deze wel herhaald te worden na de chemotherapie, minimaal 2 weken na de laatste kuur, voorafgaand aan de radiotherapie. Liefst in combinatie met de plannings CT scan in radiotherapie positie.
- Indien de FDG-PET scan voor start van de radiotherapie nog positief is, dient eindevaluatie van de respons d.m.v. FDG-PET scan plaats te vinden. Let op: pas verrichten 12 weken na afloop van de radiotherapie.
- Indien de FDG-PET scan negatief is voor start van de radiotherapie is herhaling van de FDG-PET scan niet vereist.
- Indien het resultaat van de FDG-PET scan aanleiding geeft tot het overwegen van 2de lijns salvage chemotherapie is histologische bevestiging van de persisterende/progressieve ziekte vereist.
Weglaten radiotherapie:
Indien radiotherapie kan leiden tot een grote kans op (late) toxiciteit, die gepaard gaat met ernstige blijvende morbiditeit of zelfs mortaliteit, is radiotherapie op voorhand onwenselijk. Hierbij gaat het met name om radiatiepneumonitis, cardiale toxiciteit, mammacarcinoom, infertiliteit en een blijvende droge mond.
Als alternatief vormt behandeling conform gevorderd stadium met start ABVD een goed alternatief.
Patiëntengroepen bij wie radiotherapie mogelijk op voorhand onwenselijk is:
- Bij vrouwelijke patiënten met een beperkt stadium HL, jonger dan 35 jaar, bij wie mediastinum en beide oksels zijn aangedaan en behandeling met uitsluitend chemotherapie (eventueel met radiotherapie op restafwijkingen) goed mogelijk is, is behandeling met beperkte chemotherapie en radiotherapie volgens het INRT/ISRT op voorhand onwenselijk.
- Indien het inschatten van risico’s op bijwerkingen van bestraling niet goed mogelijk is o.b.v. uitsluitend klinische criteria, wordt voorafgaand aan het vaststellen van een behandelplan een radiotherapie proefplanning geadviseerd om een inschatting te maken van risico’s op toxiciteit. Het gaat hier om bijvoorbeeld patiënten met
- Bulky mediastinale ziekte met name indien er sprake is van ingroei in de thoraxwand en/of uitgebreide pre-cardiale/para-cardiale ziekte
- Klierpathologie mediastinum én 1 oksel bij vrouwelijke patiënten met een beperkt stadium HL, jonger dan 35 jaar
- Zeer proximaal oplopende halsklier-pathologie aan beide zijden
Therapie klassiek Hodgkin lymfoom stadium I-II onder het diafragma
Patiënten met beperkt stadium HL onder het diafragma dienen te worden ingedeeld en behandeld conform patiënten met supra diafragmaal HL, inclusief interim FDG-PET sturing.
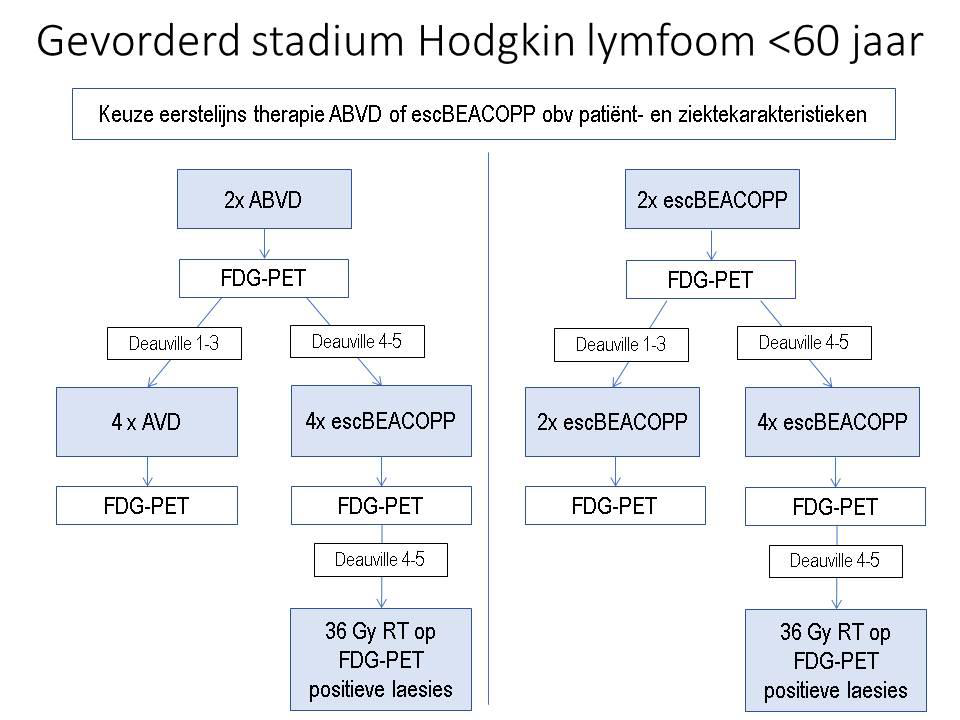
Therapie klassiek Hodgkin lymfoom, stadium III en IV
Patiënten < 60 jaar
Bij start van de behandeling dient er een keuze gemaakt te worden tussen starten met escBEACOPP of starten met ABVD. Zonder interim PET-sturing van de behandeling is de PFS en OS na behandeling met escBEACOPP beter dan na behandeling met ABVD met na 5 jaar in absolute zin een voordeel van 11% voor PFS en 3% voor OS ten opzichte van ABVD. Echter, er zijn geen rechtstreeks vergelijkende studies tussen initieel ABVD- en initieel escBEACOPP- interim PET-gestuurde behandeling. Derhalve dient de initiële behandeling in samenspraak met patiënt gekozen te worden.
Factoren die escBEACOPP minder gewenst maken zijn: leeftijd, performance score, co-morbiditeiten, fertiliteit. Echter, stadium (III/IV), tumor bulk (>7cm) en hoge IPS-score pleiten voor initiële therapie met escBEACOPP gezien de betere kans op tumor controle
De acute en late toxiciteit met escBEACOPP is hoog, met name hematologisch en infectieus en op lange termijn is het risico op infertiliteit hoog. Het risico op sAML/MDS is laag, hoewel iets hoger dan met ABVD. De therapieduur is bij escBEACOPP beduidend korter ten opzichte van ABVD, nl 12-18 weken versus 20-24 weken.
Vanwege de kans op ernstige acute toxiciteit en verhoogde therapie gerelateerde mortaliteit ≥ 60 jaar (15-20% TRM) wordt escBEACOPP afgeraden bij leeftijd ≥ 60 jaar, alsmede bij leeftijd > 40 jaar met een ECOG performance status >2 of belangrijke co-morbiditeit (15% TRM).
Concluderend kan er op basis van leeftijd, performance status, co-morbiditeit, ziektekenmerken (tumor bulk, IPS en stadium) en patiënt voorkeuren gekozen worden tussen interim PET-gestuurde behandeling met escBEACOPP dan wel interim PET-gestuurde behandeling met ABVD.
Recente studies laten zien dat sturing van de behandeling op basis van het resultaat van een interim FDG-PET/CT-scan, zowel bij initiële start met escBEACOPP als met ABVD, de uitkomst van de behandeling verbetert ten opzichte van historische controles, dan wel de blootstelling aan chemotherapie vermindert.
Responsevaluatie einde behandeling:
- Eindevaluatie van de respons vindt 4 tot 6 weken na einde van de chemotherapie plaats d.m.v. een FDG-PET scan. Alleen indien een beperkt aantal PET-positieve restlesies aanwezig zijn (Deauville score 4, 5) is hierop aanvullende radiotherapie geïndiceerd (36 Gy, 18 fracties).
- Indien radiotherapie is gegeven, dient na 12 weken de FDG-PET scan te worden herhaald. Indien de FDG-PET scan aanleiding geeft tot overwegen van salvage chemotherapie wordt histologische bevestiging van de persisterende/progressieve ziekte uitdrukkelijk geadviseerd.
Behandeling patiënten ≥ 60 jaar
Er is slechts zeer beperkt literatuur beschikbaar over behandeling van Hodgkin lymfoom bij patiënten van ≥ 60 jaar. De mate van fitheid speelt een doorslaggevende rol bij de mogelijkheden en keuze van behandeling. Een afweging of de patiënt als fit genoeg beschouwd kan worden voor behandeling met ABVD wordt overgelaten aan de behandelend arts. Een belangrijke factor daarbij is vooral de afwezigheid van pulmonale co-morbiditeit.
| Leeftijd | Stadium | Behandeladvies |
| 60-70 jaar én fit | Beperkt | Conform <60 jaar zonder escalatie naar escBEACOPP |
| Gevorderd | Conform <60 jaar met start van ABVD zonder escalatie naar escBEACOPP | |
| ≥ 70 jaar óf 60-70 jaar niet-fit |
Beperkt | 3x CHOP-21 + IN-RT |
| Gevorderd | 6x CHOP-21 + radiotherapie op PET-positieve laesies aan einde chemotherapie |
- Aan ouderen van 60-70 jaar kunnen 2 ABVD kuren zonder ernstige toxiciteit gegeven worden; indien 4 of meer kuren ABVD gegeven worden, treedt in ≥ 50% van de oudere patiënten graad 3-4 toxiciteit op, waaronder bleomycine geïnduceerde long toxiciteit.
- Bij patiënten van 60-70 jaar met gevorderd stadium HL behandeld met ABVD werden in retrospectieve analyse gunstige respons percentages en 5-jaars OS van 67% gevonden.
- Patiënten die ouder zijn dan 70 jaar of niet-fitte patiënten van 60-70 jaar ervaren veel bijwerkingen van ABVD kuren en er vindt frequent uitstel van kuren of dosis aanpassing plaats. Studie van Kolstad et al. (Kolstad, 2007) laat zien dat met CHOP-21 goede complete remissie percentages kunnen worden bereikt met 3 jaar OS 79% en PFS 76%.
Hodgkin lymfoom bij patiënten > 70 jaar
Afhankelijk van de co-morbiditeiten individualiseren.
Mogelijkheden zijn CHOP21, PECC, LOPP, EBVP of alleen RT.
| Cyclofosfamide | 750 mg/m2 | i.v. | dag 1 |
| Doxorubicine | 50 mg/m2 | i.v. | dag 1 |
| Vincristine | 1,4 mg/m2 (max. 2 mg) | i.v. | dag 1 |
| Prednisolon | 100 mg | p.o. | dag 1 t/m 5 |
| Lomustine | 80 mg/m2 | p.o. | dag 1 |
| Chloorambucil | 8 mg/m2 | p.o. | dag 1 t/m 5 |
| Etoposide | 100 mg/m2 | p.o. | dag 1 t/m 5 |
| Predniolon | 40 mg/m2 | p.o. | dag 1 t/m 5 |
Hodgkin lymfoom recidief of primair refractair
Algemeen: histologische bevestiging van het recidief dan wel refractair lymfoom is noodzakelijk: cave NHL!
Chemotherapie
Bij een recidief of refractair Hodgkin lymfoom blijkt dat hoge dosis chemotherapie gevolgd door autologe stamceltransplantatie effectiever is dan chemotherapie alleen. Er zijn geen gerandomiseerde tweedelijns chemotherapie schema’s rechtstreeks met elkaar vergeleken. Kleine fase II studies en retrospectieve analyses laten vergelijkbare overall response rates van 65-85% zien (DHAP, GDP, GVD, mini-BEAM of BEGEV).
- tweedelijns chemotherapie bij fitte patiënten zijn DHAP of GDP chemotherapie goede behandelopties, bij response gevolgd door een autologe SCT.
- ferese stamcellen: de ferese kan plaatsvinden na 1 of na 2 cycli tweedelijns chemotherapie (dus onafhankelijk van de respons)
- responsevaluatie middels FDG-PET/CT-scan dient verricht te worden na 2 cycli tweedelijns chemotherapie.
- therapieschema: 2 x DHAP of GDP á 3 weken gevolgd door FDG-PET/CT:
- Indien een complete metabole respons (CMR) is bereikt, volgt een 3e DHAP of GDP gevolgd door BEAM en ASCT.
- Indien een partiële metabole respons is bereikt, zijn er een aantal opties, al of niet rekening houdend met de wetenschap dat patiënten die een negatieve PET scan bereiken voor transplantatie een betere prognose hebben na ASCT in vergelijking met patiënten die een positieve PET scan hebben.
- Er kan gestreefd worden naar een complete metabole respons voor transplantatie met derdelijns behandeling met 3 kuren brentuximab vedotin, een ander chemotherapieschema of radiotherapie
- Er kan gecontinueerd worden met een 3e DHAP of GDP gevolgd door BEAM en ASCT
- Een andere optie is om na de ASCT aanvullende behandeling te geven, bijvoorbeeld door consolidatie met brentuximab vedotin. Of met radiotherapie bij beperkte gelokaliseerde ziekte, al of niet afhankelijk van de FDG-PET scan na ASCT.
- Bij niet bereiken van partiële respons volgt aanvullende behandeling met derdelijns therapie met in eerste instantie brentuximab vedotin monotherapie. Bij bereiken van een partiële respons of meer na brentuximab vedotin wordt gecontinueerd met BEAM en ASCT. Indien de respons op brentuximab vedotin onvoldoende is kan pembrolizumab worden gegeven.
Radiotherapie
In geselecteerde gevallen kan worden overwogen om het recidief alléén met radiotherapie te behandelen. Data in de literatuur geven een 5 jaars relapse free survival van 40% en overall survival van 50%-75%. Voorwaarde is een goede patiënten selectie:
- lokaal recidief;
- nodaal stadium I recidief
- recidief buiten bestralingsveld;
- geen B-symptomen;
- geen extranodaal recidief;
- goede performance status.
Consolidatiebehandeling
- Consolidatiebehandeling met brentuximab vedotin na autologe stamceltransplantatie kan overwogen worden bij patiënten die voor transplantatie geen CMR hebben bereikt
- Radiotherapie na autologe stamceltransplantatie als alternatieve consolidatiebehandeling op PET-positieve laesies kan overwogen worden bij patiënten die voor transplantatie geen CMR hebben bereikt
Recidief na autologe stamceltransplantatie
- Brentuximab vedotin is eerste keus, tenzij de patiënt refractair is gebleken op brentuximab vedotin
- Bij onvoldoende respons na brentuximab vedotin zijn PD-1 remmers pembrolizumab en nivolumab gelijkwaardige behandelopties
- Allogene stamceltransplantatie dient afhankelijk van leeftijd, comorbiditeit en beschikbaarheid van een donor overwogen te worden bij patiënten met responsieve ziekte bij een recidief na autologe stamceltransplantatie
DHAP (klinisch)
| Cisplatin | 100 mg/m2 | i.v. | dag 1 |
| Cytarabine | 2000 mg/m2 2 dd | i.v. | dag 2 |
| Dexamethason | 40 mg | i.v. | dag 1 t/m 4 |
| G-CSF wordt toegediend op dag 5 | |||
GDP (poliklinisch)
| Cisplatin | 75 mg/m2 | i.v. | dag 1 |
| Gemcitabine | 1000 mg/m2 | i.v. | dag 1 en dag 8 |
| Dexamethason | 40 mg | p.o. | dag 1 t/m 4 |
| G-CSF wordt toegediend op dag 9 | |||
Hodgkin lymfoom bij AIDS
Therapie individualiseren.
