De informatie in het vademecum is gebaseerd op het behandeladvies CLL van de Hovon CLL werkgroep.
Voor uitgebreide informatie en achtergrond zie daarom de Hovon website, behandeladvies Chronische Lymfatische Leukemie.
Diagnostiek
Onderzoek om de diagnose CLL te stellen
Bloedonderzoek:
- Hb, leukocyten, trombocyten, leukocyten differentiatie
- Immunofenotypering (zie tabel 1)
|
CD19 |
positief |
|
CD20 |
doorgaans zwakke expressie |
|
CD5 |
positief |
|
CD23 |
positief |
|
Kappa, Lambda |
zwakke expressie, afwijkende ratio |
|
Additionele markers |
|
|
CD200 |
positief |
|
CD43 |
positief |
|
CD79b |
zwak tot negatief |
|
Minimaal vereist |
|
Diagnose CLL (chronische lymfatische leukemie):
- circulerende monoklonale B cellen > 5 x 109/l
- immunofenotypering passend bij CLL (o.a. CD19-positief, CD5-positief, CD23-positief).
Diagnose SLL (small lymphocytic lymphoma):
- lymfadenopathie en/of splenomegalie
- circulerende monoklonale B cellen < 5 x 109/l
- in de lymfklier een celbeeld met lymfoide cellen met grumelée kernstructuur in combinatie met bij CLL/SLL passende immunofenotypering.
Diagnose monoclonale B-lymfocytose:
- circulerende monoklonale B cellen < 5 x 109/l
- geen lymfadenopathie of organomegalie, geen cytopenie en geen ziektegerelateerde symptomen.
Onderzoek vooraf aan therapie
Anamnese: WHO performance-score, koorts, gewichtsverlies, nachtzweten en infecties.
Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt.
Bloedonderzoek:
- Hb, leukocyten, trombocyten, leukocyten differentiatie
- Nierfunctie, leverfunctie, immuunglobulines, directe antiglobuline test, beta2-microglobuline
- Serologie hepatitis B, hepatitis C, HIV (reactivatie hepatitis B bekend bij behandeling met monoclonale antistoffen, en ook bij behandeling met ibrutinib)
- Cytogenetica (FISH òf Comparative Genomic Hybridization (CGH)-array): del(17p)
- Moleculair onderzoek aanwezigheid TP53-mutatie (OF mutatie aangetoond met Sanger sequencing OF mutaties >10% met next generation sequencing)
- IGVH mutatie status indien consequenties voor therapie-keuze dan wel nodig in studieverband
Beenmergonderzoek: indien trombocytopenie of anemie (vraagstelling: verdringing of auto-immuun afbraak)
Beeldvorming:
- X thorax (vraagstelling: lymfadenopathie, aanwijzing voor infectie, andere longafwijkingen)
- CT hals, thorax, abdomen volgens Cheson criteria beoordelen (achterwege laten indien geen consequenties voor inschatten tumorlyse risico of voor respons evaluatie)
Stadiëring
- Stadiëring volgens Rai en Binet (en indien studiebehandeling: volgens CLL-IPI score (tabel 2 en 3 en 4)
- Vaststellen actieve ziekte (tabel 5)
- Vaststellen behandel indicatie (tabel 6)
Rai-classificatie
| Risico | Stadium | Definitie | Overleving mediaan (jaar) |
|---|---|---|---|
| Laag risico | 0 |
|
> 10 |
| Intermediair | I |
|
> 8 |
| II |
|
> 8 | |
| Hoog | III |
|
6,5 |
| IV |
|
6,5 | |
| * indien anemie en trombocytopenie niet veroorzaakt wordt door autoantistoffen ** mediane overleving uit de tijd voordat BTK-remmers en bcl-2 remmers beschikbaar waren |
|||
Binet-classificatie
| * indien anemie en trombocytopenie niet veroorzaakt wordt door autoantistoffen ** mediane overleving uit de tijd voordat BTK-remmers en bcl-2 remmers beschikbaar waren |
|||
| Risico | Stadium | Definitie | Overleving mediaan (jaar) |
| Laag risico | A |
|
> 10 |
| Intermediair | B |
|
> 8 |
| Hoog | C |
|
6,5 |
Stadiëring volgens CLL-IPI score
| Variabele | Punten |
| TP53-mutatie en/of 17p deletie | 4 |
| IGHV ongemuteerde status | 2 |
| Beta2-microglobuline > 3,5 mg/L | 2 |
| Binet stadium B/C of Rai stadium I-IV | 1 |
| Leeftijd > 65 jaar | 1 |
| Prognostische score | 5-jrs OS, % |
| Laag, 0-1 | 93,2 |
| Intermediair, 2-3 | 79,4 |
| Hoog, 4-6 | 63,6 |
| Zeer hoog, 7-10 | 23,3 |
Criteria actieve ziekte
|
1. |
Minstens 1 van de volgende ziektegerelateerde symptomen: a. Gewichtsverlies ≥ 10% in voorafgaande 6 maanden b. Extreme vermoeidheid (WHO performance status ≥ 2) c. Koorts ≥ 38.6°C gedurende ≥ 2 weken, in afwezigheid van infecties d. Nachtzweten gedurende meer dan een maand zonder aanwijzing voor infectie |
|
2. |
Toenemend beenmergfalen, zich uitend in ontwikkeling van of verergering van anemie en/of trombocytopenie |
|
3. |
Auto-immuun anemie en/of trombocytopenie die slecht reageert op behandeling met steroïden |
|
4. |
Massale (> 6 cm onder linker ribbenboog) of progressieve splenomegalie |
|
5. |
Massale klieren of pakketten (> 10 cm in grootste diameter) of progressieve lymfadenopathie |
|
6. |
Progressieve lymfocytose met een stijging > 50% binnen 2 maanden, of een geanticipeerde verdubbelingstijd van minder dan 6 maanden |
Behandeling
Behandelindicatie
Er bestaat geen behandelindicatie voor patiënten met laag-risico CLL (Binet-A of RAI-0).
|
Behandeling Rai 0/ Binet A |
Nee |
|
Behandeling Rai I/II of Binet B |
Mogelijk (indien actieve ziekte; zie tabel 5) |
|
Behandeling Rai III/IV of Binet C |
Ja |
Open/geplande HOVON studies
Zie HOVON.
1e lijns behandeling
De keuze van de behandeling hangt af van aanwezigheid van del(17p) of TP53 mutatie èn van de fitheid van de patiënt.
Prognostische bepalingen bij behandelindicatie (1e lijn of recidief)
Bloedonderzoek:
Cytogenetica (FISH) voor del(13q), del(11q), del(17p), trisomie 12.
Moleculair onderzoek aanwezigheid TP53-mutatie. IGHV mutatiestatus (achterwege laten indien geen consequentie voor therapie-keuze)
Onderzoek fitheid: (tabel 7) en weeg het belang van verbeterde progressievrije overleving af tegen toxiciteit van de behandeling.
|
Fit |
Patiënten zonder co-morbiditeit ( doorgaans jonger dan 65-70) |
|
Minder fit |
Patiënten met enige comorbiditeit; WHO 0-2* |
|
Niet fit |
Patiënten met ernstige comorbiditeit; WHO 3-4* |
|
* indien niet veroorzaakt door ziekte activiteit (cytopenie, lymfadenopathie, B symptomen) |
|
Fitte patiënten, < 65 jaar, indien géén del(17p) of TP53
Buiten studie:
- Fludarabine-cyclofosfamide-rituximab (FCR)
| Rituximab | ∗375 mg/m2 | i.v. | dag 1 |
| Fludarabine | 40 mg/m2 | p.o | dag 1-3 |
| Cyclofosfamide | 250 mg/m2 | p.o | dag 1-3 |
| Kuur herhalen op dag 29 | bij respons 6 kuren | ||
| ∗: dosis rituximab eerste kuur 375 mg/m2, latere kuren 500 mg/m2 PCP profylaxe met cotrimoxazol 480 mg en Herpes profylaxe met valaciclovir 2 x 500 mg per dag ; bestraalde bloedproducten tot 1 jaar na laatste kuur |
|||
Fitte patiënten*, > 65 jaar
* Contra-indicatie voor FCR (op basis van oudere leeftijd, risico op toxiciteit, nierfunctiestoornis of patiënt voorkeur)
Buiten studie:
- Bendamustine-Rituximab
Bendamustine-Rituximab Bendamustine 90 mg/m2 i.v. dag 1-2 Rituximab *375 mg/m2 i.v. dag 1 Kuur herhalen op dag 29 streef naar 6 cycli ∗: dosis rituximab eerste kuur 375 mg/m2, latere kuren 500 mg/m2
PCP (cotrimoxazol) en Herpes profylaxe (valaciclovir) tot 6 maanden na laatste gift ;
N.B. geen cotrimoxazol op dagen van bendamustine i.v.m. kans op Stevens-Johnson syndroom
Niet-fitte patiënten*, > 65 jaar
IGHV gemuteerd:
- Chloorambucil + obinutuzumab (Chl + G)
- Chloorambucil + rituximab (Chl + R)
- Ibrutinib
IGHV ongemuteerd:
- Chloorambucil + obinutuzumab (Chl + G) òf ibrutinib
- Chloorambucil + rituximab (Chl + R) òf ibrutinib
Voor patiënten > 65 jaar of niet fit, zie patiënten keuzehulp: https://www.keuzehulp.info/pp/cll/intro
- Chloorambucil met monoklonale anti-CD20:
Meerdere chloorambucil schema’s zijn in gebruik, bijvoorbeeld:
– Chloorambucil 10 mg/m2 per os, dag 1-7, à 4 weken
– Alternatief: Chloorambucil 0,1 – 0,15 mg/kg/dag per os continu, tot maximale respons, maximaal 1 jaar.
Indicaties voor specifieke monoklonale anti-CD20: bij niet fitte patiënten dient een individuele afweging gemaakt te worden waarbij het nastreven van een zo lang mogelijke progressie vrije overleving (chloorambucil-obinutuzumab) wordt afgezet tegen het zo veel mogelijk beperken van de toxiciteit van de behandeling (chloorambucil met of zonder rituximab). Bij obinutuzumab worden meer infusiegerelateerde bijwerkingen gezien.
| Chloorambucil | 10 mg/m2 | dag 1-7 | |
| Obinutuzumab | 1e gift | 100 mg | dag 1 |
| 900 mg | dag 2 | ||
| daarna | 1000 mg | dag 8,15 | |
| Bij volgende kuren: alleen 1000 mg dag 1 | |||
| Kuur herhalen op dag 29. Streef naar 6 kuren |
|||
Indien del(17p) of TP53-mutatie aanwezig:
A. Ibrutinib monotherapie 1dd 420 mg, per os, continu tot aan progressie.
Specifieke bijwerkingen ibrutinib:
- Verhoogd bloedingsrisico;
- Absolute contra-indicatie voor ibrutinib indien gebruik van vitamine-K-antagonist en een trombocytenaggregatieremmer of dubbele trombocytenaggregatieremmers.
- Switch bij voorkeur vitamine-K-antagonist naar een DOAC
- Staak ibrutinib 3-7 dagen rondom invasieve ingrepen
- Staak ibrutinib bij een ernstige bloeding en dien trombocytentransfusie toe
- Atriumfibrilleren
- Ibrutinib kan gecontinueerd worden bij atriumfibrilleren
- Gebruik bij voorkeur een beta-blokker als anti-arrythmica (gezien interactie van andere arrythmica en ibrutinib)
- Start bij voorkeur een DOAC als antistolling noodzakelijk is
- Hypertensie
- Controleer elk polibezoek de bloeddruk en behandel zo nodig met een antihypertensivum
- Omgaan t.a.v. CYP3A4 remmers en inductoren bij ibrutinib (check farmacotherapeutisch kompas!)
- Absolute contra-indicatie voor sterke CYP3A4 remmers zoals azolen
- Relatieve contra-indicatie voor CYP3A4 remmers zoals verapamil, diltiazem, amiodarone, en P-glyco-proteinesubstraten zoals digoxine; overweeg dosis reductie van ibrutinib
Een specifiek fenomeen van behandeling met kinase remmers is een tijdelijke toename van lymfocytose in combinatie met een snelle afname van lymfadenopathie in de eerste weken na start van de therapie.
B. Venetoclax
- Venetoclax is niet getest bij nierfunctiestoornissen met een klaring < 30 ml/min en voorzichtigheid is daarom geboden
- NB Grootste risico bij venetoclax: Tumor lysis syndroom (TLS). Gebruik ramp-up schema, en bepaal TLS risico.
- Ramp-up schema volgen, daarna 1 dd 400 mg tot progressie.
| Venetoclax | 20 mg | week 1 | dag 1-7 |
| Venetoclax | 50 mg | week 2 | dag 8-14 |
| Venetoclax | 100 mg | week 3 | dag 15-21 |
| Venetoclax | 200 mg | week 4 | dag 22-28 |
| Venetoclax | 400 mg | week 5 e.v. | dag 1-28 |
| TLS risico-categorie | grootste diameter van alle meetbare lymfklieren | absolute lymfocyten aantal | GFR | ||
| laag | < 5 cm | EN | < 25 x 109/L | EN | > 50 ml/min |
| intermediair | ≥ 5 en < 10 cm | OF | ≥ 25 x 109/L | EN | > 50 ml/min |
| hoog | ≥ 5 en < 10 cm | EN | ≥ 25 x 109/L | OF | 30-50 ml/min |
| > 10 cm | irrelevant |
Hoog risico patiënten moeten worden opgenomen en behandeld volgens onderstaande schema:
| TLS risico categorie | Voorzorgsmaatregelen | Laboratorium bepaling *** | |
| Hydratie | Remming urinezuurvorming | Setting and frequentie van laboratorium bepalingen | |
| Laag | Oraal (1.5-2 L) * | Allopurinol** | Poliklinisch: 1. Vòòr start én 6 tot 8 uur én 24 uur na 1e gift van 20 mg en 50 mg 2. Alleen vòòr start bij 1e gift van 100 mg, 200 mg, 300 mg en 400 mg |
| Intermediair | Oraal (1.5-2 L) * en overweeg intraveneus op dagen van start venetoclax en bij 1e ophoging naar 50 mg venetoclax |
Allopurinol** | Poliklinisch: 1. Vòòr start én 6 tot 8 uur én 24 uur na 1e gift van 20 mg en 50 mg 2. Alleen vòòr start bij 1e gift van 100 mg, 200 mg, 300 mg en 400 mg |
| Hoog | Oraal (1.5-2 L)* en intraveneus (100-200 mL/hr) tot in ieder geval 24 uur na 1e gift van 20 mg en 50 mg |
Allopurinol** Rasburicase wordt aanbevolen indien urinezuur is verhoogd** |
Klinische opname bij start van 1e gift van 20 mg en 50 mg 1. Vòòr start én 6 tot 8 uur én 24 uur na 1e gift van 20 mg en 50 mg Poliklinisch bij start van volgende doseringen met lab als bij 1. |
| * Gedurende de gehele ramp-up periode **allopurinol moet niet worden gegeven op dagen van rasburicase ***De volgende laboratoriumbepalingen dienen bepaald te worden:
|
|||
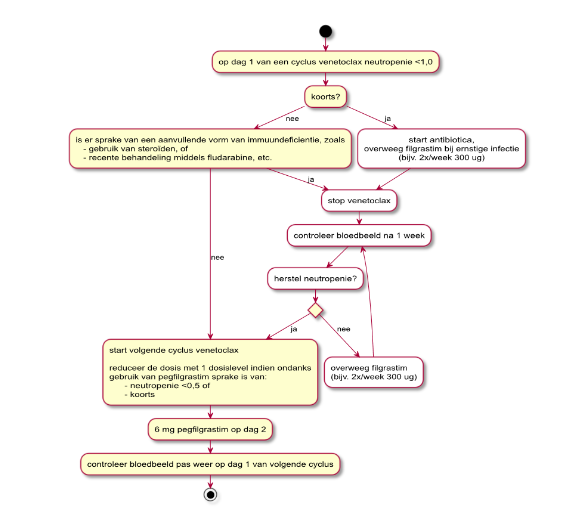
Neutropenie bij venetoclax treedt vaak op waarvoor G-CSF (pegfilgrastim of filgrastim) wordt geadviseerd. Meestal volstaat pegfilgrastim 6 mg 1 keer per 4 weken.
Figuur 1: G-CSF indien neutropenie bij Venetoclax
C. Idelalisib
Idelalisib gecombineerd met rituximab, indien contra-indicatie voor zowel ibrutinib als venetoclax.
Idelalisib geeft meer toxiciteit (hepatitis, diarree) en kans op ernstige infecties (PCP, CMV)
| Idelalisib | – | 2 dd 150 mg | p.o. | continu |
| Rituximab | week 1 | 375 mg/m2 | – | dag 1 |
| week 3, 5, 7, 9, 13, 17, 21 | 500 mg/m2 | – | dag 1 |
Specifiek bijwerkingen idelalisib:
- Diarree en pneumonitis
- Staak idelalisib bij graad 1-2 diarree die langer dan 3 dagen aanhoudt en bij graad 3-4 diarree
- Staak idelalisib zo nodig bij longklachten en hoge resolutie CT-afwijkingen niet passend bij lobaire pneumonie
- Dien zo nodig corticosteroiden toe
- Transaminitis
- Monitor frequent ASAT en ALAT, met name in de 1e 3 maanden
- Staak zo nodig idelalisib of dien corticosteroiden toe
N.B.Idelalisib mag niet worden geïnitieerd bij patiënten met enige aanwijzing van nog aanwezige, systemische bacteriële infectie, schimmelinfectie of virale infectie
Algemeen
Infectie preventie
- PJP profylaxe met cotrimoxazol 1 dd 480 mg, tot 6 maanden na FCR, bendamustine-rituximab en idelalisib-rituximab
- VZV/HSV profylaxe met valaciclovir 2 dd 500 mg
- Geen standaard PJP-, herpes- en anti-schimmel profylaxe bij ibrutinib en venetoclax
- Monitoring CMV-infectie bij idelalisib, bijvoorbeeld 1x per maand
Behandeling recidief
Buiten studie: Check altijd opnieuw of er een del(17p) of TP53-mutatie aanwezig is.
Figuur 2: Stappenplan behandeling recidief CLL
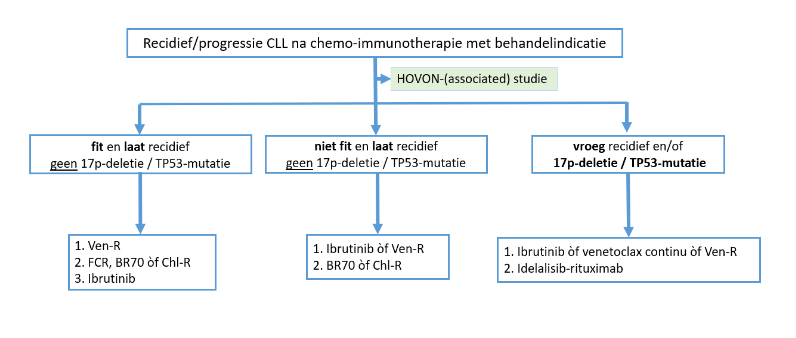
Behandeling laat recidief zonder del(17p) en/of TP53-mutatie:
Fitte patiënten, ≤ 65-70 jaar, met behandelindicatie tenminste 4-6 jaar na FCR:
1e keus: Venetoclax-rituximab (Ven-R)
2e keus: Chemo-immunotherapie (FCR*, BR70**, Chl-R)
3e keus: Ibrutinib
* opnieuw behandelen met FCR heeft verhoogd risico op toxiciteit met name secundaire MDS en acute leukemie
**respons na eerdere bendamustine-rituximab dient ten minste 3 jaar geduurd te hebben om nogmaals te herhalen
- Venetoclax-Rituximab
Venetoclax-Rituximab Venetoclax volgens rampup schema Rituximab 375 mg/m2 i.v. dag 1 Kuur herhalen op dag 29 maximaal 24 cycli venetoclax, met 6 cycli rituximab N.B. start rituximab na voltooien van ramp-up, dus na 5 weken dosisopbouw. Eerste infusie 375 mg/m2, bij kuren 2 t/m 6: 500 mg/m2
PCP en Herpes profylaxe tot 6 maanden na laatste gift - Bendamustine-Rituximab
Bendamustine-Rituximab (BR70) Bendamustine 70 mg/m2 i.v. dag 1-2 Rituximab 375 mg/m2 i.v. dag 1 Kuur herhalen op dag 29 Streef naar 6 cycli N.B. dosis rituximab eerste kuur 375 mg/m2, latere kuren 500 mg/m2
PCP en Herpes profylaxe tot 6 maanden na laatste gift.
N.B. geen cotrimoxazol op dagen van bendamustine i.v.m.kans op Stevens-Johnson syndroom
Niet fitte patiënten met behandelindicatie tenminste 3 jaar na bendamustine-rituximab of tenminste 12 maanden na chloorambucil bevattende therapie:
- 1e keus: Ibrutinib of venetoclax of venetoclax-rituximab (Ven-R)
- 2e keus: Bendamustine-rituximab (BR70), Chl-R
- Symptomatische lymfadenopathie bij patiënt met contra-indicatie voor systemische therapie: overweeg radiotherapie 2 x 2 Gy.
Behandeling vroeg recidief, refractaire ziekte of recidief met del(17p) of TP53-mutatie
1e keus: ibrutinib of of venetoclax of venetoclax-rituximab (Ven-R)
2e keus: idelalisib-rituximab
Overweeg allogene stamceltransplantatie
Behandeling recidief of refractaire ziekte na doelgerichte therapie (ibrutinib, venetoclax of idelalisib)
Figuur 3: Stappenplan behandeling recidief of refractaire ziekte na doelgerichte therapie
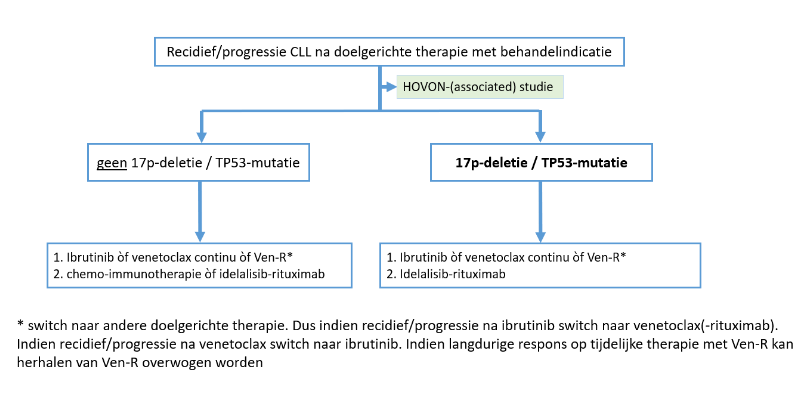
1e keus: ibrutinib òf venetoclax continu òf venetoclax-rituximab (Ven-R)
2e keus: chemo-imunotherapie (als geen 17p-deletie/TP53-mutatie) òf idelalisib-rituximab
Overweeg allogene stamceltransplantatie
Figuur 4: Overwegingen voor allogene stamceltransplantatie
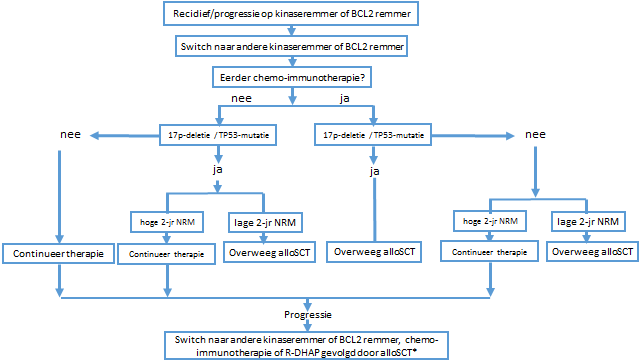
Overweeg allogene stamceltransplantatie bij:
- Een patiënt met
- aanwezigheid van del(17p) en/of TP53-mutatie
- recidief/refractaire CLL na chemo-immunotherapie en recidief òf refractair na kinaseremmers (ibrutinib of idelalisib) of venetoclax
- Een patient met lage kans op 2-jaar NRM* en:
- recidief/refractaire CLL na chemo-immunotherapie en recidief òf refractair na kinaseremmers (ibrutinib of idelalisib) of venetoclax
- Een patient met lage kans op 2-jaar NRM* en:
- 17p-deletie en/of TP53-mutatie
- Recidief of refractaire CLL na kinaseremmers (ibrutinib of idelalisib) of venetoclax
- Patiënt die refractair is op zowel kinaseremmers (ibrutinib of idelalisib) als venetoclax
- Patiënt met een klonaal gerelateerde Richterse transformatie naar DLBCL
*Een lage kans op 2-jaar Non-relapse mortality (NRM): factoren die dit beïnvloeden zijn hogere leeftijd, slechte ‘WHO performance’-score, geen 10/10 HLA-gematchte donor en vrouwelijke donor voor mannelijke patiënt en comorbiditeit
Bij refractaire CLL op zowel kinaseremmers als venetoclax is R-DHAP een effectieve inductie, ook voor patiënten met een del(17p) en/of TP53-mutatie. Een alternatieve mogelijkheid voor inductie is een schema volgens Castro met hoge dosis methylprednisolon in combinatie met rituximab
| Dexamethason | 40 mg i.v. of p.o. | dag 1-4 |
| Cytarabine | 2 dd 2000 mg/m2 | dag 2 |
| Cisplatin | 100 mg/m2 | dag 1 |
| Rituximab | 375 mg/m2 i.v. | dag 1 |
| Kuur herhalen op dag 29 (afhankelijk van donorbeschikbaarheid 3-6 kuren) | ||
| N.B. dosis Rituximab eerste kuur 375 mg/m2, daarna 500 mg/m2 Denk aan SDD profylaxe |
||
| methylprednison | 1 g/m2 i.v. | dag 1-5 |
| Rituximab |
cyclus 1: 375 mg/m2 i.v. cyclus 2-3: 375 mg/m2 |
dag 1, 3, 5, 8, 17, 22 dag 1, 7, 14, 21 |
| Kuur herhalen op dag 29 (maximaal 3 kuren) | ||
- Overweeg inclusie in fase I/II studie: (zie o.a HOVON)
Behandeling complicaties van CLL
- Warmte auto-immuun anemie of trombopenie:
- Prednison 1 mg/kg
- Indien geen respons op prednison: Rituximab 4 x 375 mg/m2 à 1 week (alternatief splenectomie)
- Indien geen respons op rituximab: CLL behandeling (alternatief splenectomie)
- Koude antistoffen hemolytische anemie:
- Rituximab 4 x 375 mg/m2 à 1 week
- Indien geen respons op Rituximab: CLL behandeling
- Immuun cytopenie na purine analogen:
- Staken purine analogen, start prednison 1 mg/kg
- Indien geen verbetering: overweeg ciclosporine toevoegen
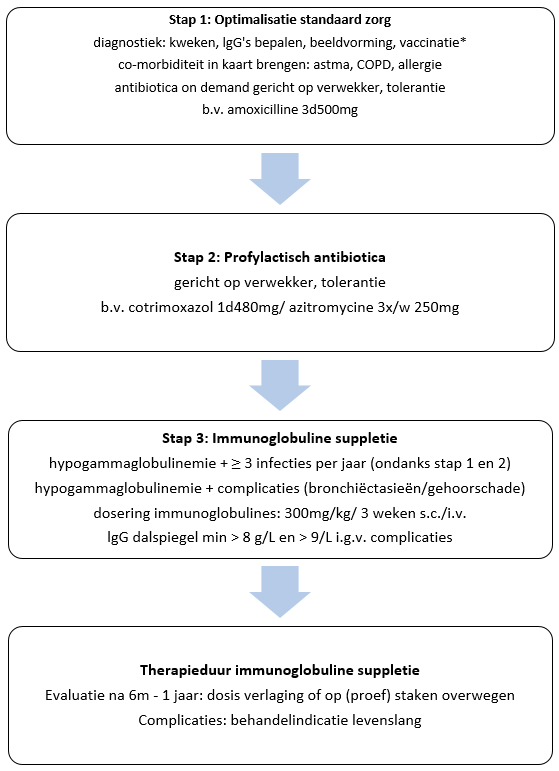
- Recidiverende luchtweginfecties
- Naast diagnostiek wordt antibiotica on demand aanbevolen
- Indien ≥3 infecties per jaar profylactische antibiotica, cotrimoxazol 1dd 480 mg, azitromycine 3x per week 250 mg of doxycycline 1dd 100mg
- Hypogammaglobulinemie:
Overweeg immunoglobuline suppletie bij:- hypogammaglobulinemie en recidiverende infecties ≥ 3x per jaar ondanks profylactische antibiotica
- hypogammaglobulinemie en complicaties van recidiverende infecties zoals longschade (bronchiëctasieën)
Dosering immuunglobulines 100 mg/kg/week of 400 mg/kg per 4 weken (iv of sc). Streef naar een dalspiegel van > 5 g/L bij recidiverende infecties of > 8 g/L bij complicaties (bronchiëctasieën/gehoorschade).
Effect van immuunglobuline suppletie na 6 maanden tot 1 jaar evalueren. Indien infecties onder controle kan dosisverlaging of op proef staken overwogen worden. Bij patiënten met complicaties is levenslange immuunglobuline suppletie geïndiceerd
Figuur 5: Stappenplan behandeling recidiverende infecties:
Follow-up bij rustige CLL
Controle elke 3-12 maanden, afhankelijk van beloop
- Anamnese: “WHO performance”-score, koorts, gewichtsverlies, nachtzweten en infecties.
- Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt.
- Bloedonderzoek: Hb, leukocyten, trombocyten, leukocyten differentiatie.
Follow-up CLL met behandeling
- Anamnese: WHO performance-score, koorts, gewichtsverlies, nachtzweten en infecties.
- Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt.
- Bloedonderzoek: Hb, leukocyten, trombocyten, leukocyten differentiatie.
- Beenmergonderzoek: indien cytopenie of indien consequenties bij complete remissie of minimale rest ziekte (zoals in studies).
- Beeldvorming: CT hals, thorax, abdomen volgens Cheson criteria (achterwege laten indien geen consequenties).
Respons
|
|
Complete remissie |
Partiële remissie |
Progressieve ziekte |
|
|
Response definitie: |
Alle criteria nodig |
Tenminste 2 criteria van A plus 1 criterium van B |
Tenminste 1 criterium |
|
|---|---|---|---|---|
|
A |
Lymfadenopathie |
Afwezig (geen ≥ 1.5 cm) |
≥ 50% afname vanaf start, |
≥ 50% toename vanaf start of respons |
|
|
Hepato/spleno megalie |
miltgrootte < 13 cm |
≥ 50% afname vanaf start |
≥ 50% toename vanaf start of respons |
|
|
B-symptomen |
Afwezig |
Niet van toepassing |
Niet van toepassing |
|
|
Bloed lymfocyten |
Normaal, < 4,0 x 109/l |
≥ 50% afname vanaf start |
≥ 50% toename vanaf start (≥ 5,0 x 109/cellen) |
|
B |
Trombocyten |
≥ 100 x 109/l |
≥ 100 x 109/l of ≥ 50% toename vanaf start |
≥ 50% afname vanaf start secundair aan CLL |
|
|
Hemoglobine |
> 6.8 mmol/l |
> 6.8 mmol/l of ≥ 50% |
Afname > 1.3 mmol/l vanaf start secundair aan CLL |
|
Beenmerg |
Normocellulair, geen CLL cellen, |
Aanwezigheid van CLL cellen of B-lymfoide nodi, of niet verricht |
≥ 50% toename van CLL cellen |
